ALM aktuell 04/2022
IVDR: Wird die europäische Regulierung zur Innovationsbremse?
Mit der Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR) werden Regeln für das Inverkehrbringen, die Bereitstellung auf dem Markt und die Inbetriebnahme von für den menschlichen Gebrauch bestimmten In-vitro-Diagnostika (IVD) und deren Zubehör in der Europäischen Union festgelegt. Die Verordnung tritt am 26.05.2022 in Kraft und ersetzt die seit 1998 gültige Richtlinie 98/79/EG über In-vitro-Diagnostika. Ziel der Verordnung ist es, einen reibungslos funktionierenden Binnenmarkt für IVD und ein hohes Maß an Qualität im Sinne der Patientensicherheit durch standardisierte Maßnahmen zu gewährleisten.
Dr. Felix Stelter

Allein der Umfang der deutschen Fassung hat sich von 46 auf 157 Seiten mehr als verdreifacht. Im selben Maße dürften auch die Anforderungen an die Diagnostika-Hersteller gestiegen sein. Hohe Hürden bei der Zulassung eines Labortestes heben zweifellos langfristig das Niveau der auf dem Markt befindlichen diagnostischen Tests, können aber auch als Innovationsbremse wirken. Zunächst einmal haben sie unmittelbare praktische Konsequenzen, mit denen die Labore trotz verlängerter Übergangsfristen bereits jetzt konfrontiert sind.
Viele Labore mussten in den letzten Wochen von ihren Zulieferern erfahren, dass bestimmte Reagenzien und Tests ab dem 26.05.2022 nicht mehr verfügbar sein werden. Auch wenn sich darunter einige obsolete Verfahren befinden, gilt für viele dieser Tests, dass die medizinischen Fragestellungen zu selten, die Patientengruppen zu klein oder der mit den Test zu erzielende Umsatz zu gering sind, um sie unter den Bedingungen der IVDR zukünftig zuzulassen und erfolgreich zu vermarkten.
Einige dieser Tests werden deshalb wohl nur noch für Forschungszwecke (Research Use Only, RUO) angeboten werden. RUO-Tests können unter ärztlicher Kontrolle als sogenanntes In-vitro-Diagnostikum aus Eigenherstellung – auch als Inhouse- oder Laboratory Developed Test (LDT) bezeichnet, weiterhin zur Diagnostik am Menschen eingesetzt werden. Die Anwendung fällt ebenfalls unter die neue IVDR, nur dass die Verantwortung vom Testhersteller vollständig auf den Anwender verlagert wird.
Nicht nur deshalb lohnt es sich, das Thema In-vitro-Diagnostika aus Eigenherstellung unter den Bedingungen der IVDR ausführlicher zu beleuchten. Die Anforderungen an diese Tests sind im Kapitel II, Artikel 5 (5) festgeschrieben. Diese Vorgaben müssen alle Labore erfüllen, die In-house-Tests zur medizinischen Diagnostik einsetzen. Betroffen sind davon keineswegs nur einige wenige Speziallaboratorien, sondern mehr oder weniger alle in Deutschland tätigen Labore.

Bedeutung der Inhouse-Tests für die laboratoriumsmedizinische Diagnostik in Deutschland
Viele Inhouse-Tests werden eingesetzt, um den Bedürfnissen besonderer, oftmals sehr kleiner Patientengruppen gerecht zu werden. Es existieren zahlreiche seltene und sehr seltene Erkrankungen, deren Diagnostik ausschließlich mit Inhouse-Testverfahren möglich ist. Im Labor sind Inhouse-Tests vor allem in den Bereichen Humangenetik, Toxikologie und Umweltanalytik, Autoimmundiagnostik und molekulare Erregerdiagnostik etabliert. Bezogen auf die Gesamtmenge der durchgeführten Tests ist die Zahl der mit solchen Tests ermittelten Laborergebnisse zwar gering, die Zahl der in den Laboren genutzten Inhouse-Verfahren bezogen auf die Gesamtzahl der Untersuchungsverfahren aber erheblich größer.
Gerade die SARS-CoV-2-Pandemie hat uns vor Augen geführt, dass beim Auftreten neuer gefährlicher Infektionserreger Inhouse-Testverfahren eine besondere Bedeutung zukommt. Bereits zwei Wochen nach Bekanntwerden von COVID- 19 im Januar 2020 war der Nachweis von SARS-CoV-2 in einigen Mitgliedslaboren des ALM e.V. möglich. Verschiedene PCR-Verfahren wurden auf der Basis der von Prof. Drosten publizierten Primersequenzen als Inhouse-Tests in den Laboren etabliert und erst später sukzessive durch CE-zugelassene Testverfahren ersetzt. Die molekulare Surveillance des sich schnell verändernden Virus stützt sich bis heute ausschließlich auf Inhouse-Testverfahren.
Am Pandemiebeispiel wird deutlich, dass Inhouse-Tests eine wesentliche Brückenfunktion von der Grundlagenforschung zur breiten diagnostischen An-wendung erfüllen. Im Grunde genommen beginnt jede labordiagnostische Innovation ihren Lebenszyklus als IVD aus Eigenherstellung in einem medizinischen Labor.
Die Herstellung und Konfektionierung von Inhouse-Tests in den fachärztlich-medizinischen Laboratorien unterscheidet sich grundlegend von der Herstellung im industriellen Maßstab in Diagnostika-Unternehmen. In der Regel erwerben Labore verschiedene Komponenten (Reagenzien, Plastikmaterial, Geräte) und kombinieren diese zu einem Testverfahren oder Prozess auf Basis einer Arbeitsanweisung.
Unter ‚Inhouse-Test‘ fällt auch die Verwendung eines für Forschungszwecke (RUO) vertriebenen Tests sowie der Einsatz eines CE-zugelassenen Testverfahrens außerhalb der vom Hersteller definierten Zweckbestimmung. Weiterhin wird ein CE-zugelassener diagnostischer Test zu einem IVD aus Eigenherstellung, wenn im Labor einzelne Komponenten ausgetauscht oder andere Probenmaterialien verwendet werden.
Nicht zuletzt stellt jede Software, die zur Auswertung und Interpretation von Patientenergebnissen im Labor verwendet wird, ein IVD dar. Demzufolge zählt jede adaptierte oder selbst entwickelte Software, die im diagnostischen Prozess zum Einsatz kommt, dem Gesetzestext nach als In-vitro-Diagnostikum aus Eigenherstellung und unterliegt ebenfalls den Anforderungen von Artikel 5 (5) der IVDR. Solche Inhouse-Software wird an vielen Stellen genutzt: angefangen bei einfachen Excel-Sheets zur Kalkulation von Scores über mathematische Algorithmen zur Auswertung von Messdaten und Expertensystemen zur Integration von Messergebnissen bis hin zu hochkomplexen Bioinformatiktools und Datenbanken für die Hochdurchsatzsequenzierung.
Medizinische Laboratoriumsdiagnostik unterliegt in Deutschland dem Arztvorbehalt. Damit wird sichergestellt, dass alle Tests – erst recht die aus Eigenherstellung – ärztlich validiert und verantwortet werden. Mit dem Arztvorbehalt wird auch dem Laborarzt eine Diagnose- und Behandlungsfreiheit eingeräumt, von der er nach bestem Wissen und Gewissen Gebrauch machen kann und muss. Die Einhaltung der durch die RiliBÄK gesetzten hohen Qualitätsstandards ist dabei verpflichtend. Viele Labore sind darüber hinaus zusätzlich und freiwillig nach der EN ISO 15189 oder nach anderen Standards akkreditiert bzw. zertifiziert.
Regelungen im Artikel 5 (5) der IVDR und wie sie aus Sicht der Labore in der Praxis gehandhabt werden sollten:
Artikel 5 (5): für IVD aus Eigenherstellung gelten die grundlegenden Sicherheits- und Leistungsanforderungen gemäß Anhang I
Anhang I ist ein detaillierter und umfassender Katalog von Leistungs- und Sicherheitsmerkmalen, Kennzeichnungen und Gebrauchsanweisungen. Die wesentlichen für die Patientensicherheit relevanten Anforderungen finden sich in Anhang I, Kapitel II „Anforderungen an Leistung, Auslegung und Herstellung“, Absatz 9. „Leistungsmerkmale“. Diese sind im Kern sowohl in der RiliBÄK als auch in der EN ISO 15189 enthalten. Viele weitere im Anhang I formulierte Anforderungen sind selbstverständlicher Bestandteil des Arbeits-, Umwelt- und Infektionsschutzes in den Laboren.
Für die Erfüllung der sich aus Artikel 5 (5), Buchstaben e) bis i) ergebenden Dokumentationspflichten sind im Labor keine zusätzlichen Ressourcen vorhanden, ebenso wenig entsteht aus Erstellung weiterer Dokumente zusätzlicher Patientennutzen. Der Dokumentationsaufwand für im Labor genutzte Inhouse-Tests muss deshalb auf tatsächlich relevante und kritische Punkte begrenzt bleiben. Dafür sollten bereits existierende, auf Grundlage der RiliBÄK bzw. der EN ISO 15189 erstellte Verfahrensanweisungen und Dokumentationen völlig ausreichend sein.
Artikel 5 (5) a) Die Produkte werden nicht an eine andere rechtlich eigenständige Einrichtung abgegeben
Artikel 5 (5) b) die Herstellung und die Verwendung der Produkte erfolgen im Rahmen geeigneter Qualitätsmanagementsysteme; c) das Labor der Gesundheitseinrichtung entspricht der Norm EN ISO 15189 oder gegebenenfalls nationalen Vorschriften einschließlich nationaler Akkreditierungsvorschriften
Für in Deutschland tätigen medizinische Labore sollte es als ausreichend erachtet werden, wenn Inhouse-Tests unter Einhaltung der RiliBÄK hergestellt, validiert und verwendet werden. Die freiwillige zusätzliche Anwendung der EN ISO 15189 steht dem nicht entgegen.
Artikel 5 (5) d) die Gesundheitseinrichtung liefert in ihrer Dokumentation eine Begründung dafür, dass die spezifischen Erfordernisse der Patientenzielgruppe nicht bzw. nicht auf dem angezeigten Leistungsniveau durch ein gleichartiges auf dem Markt befindliches Produkt befriedigt werden können
Im Umkehrschluss resultiert aus dieser Forderung der formale Zwang, die Nutzung eines Inhouse-Tests einzustellen, wenn ein kommerziell hergestelltes Produkt mit mindestens gleichen Leistungsdaten verfügbar ist. Bereits die verwendeten Begriffe sind unscharf definiert und unter den spezifischen Bedingungen eines Laborstandortes weit auslegbar (ausführlicher Kommentar in der Stellungnahme der Ad-hoc-Kommission der AWMF). Deshalb wird diese Forderung unter praktischen Gesichtspunkten kaum umsetzbar sein. Außerdem stellt der Zwang, ein bestimmtes Verfahren nur deshalb einem anderen vorzuziehen, weil es kommerziell hergestellt wurde, einen Eingriff in die ärztliche Diagnose- und Behandlungsfreiheit dar.
Zahlreiche Inhouse-Tests sind seit Jahren sicher in der Routineversorgung etabliert und auch über die Longitudinalbetrachtung von Einzelergebnissen in der Patientenversorgung medizinisch sehr wertvoll. Insbesondere bei seltenen Erkrankungen wäre eine Testumstellung fachlich nicht sinnvoll und auch aufgrund z. B. geringer Probenzahlen im Sinne einer adäquaten Validation nur über lange Zeiträume möglich. Auch für häufigere Erkrankungen stellen Inhouse entwickelte und validierte Tests einen Innovationstreiber für die Patientenversorgung dar.
Der Anreiz für Labore, Tests selbst zu entwickeln und damit Impulsgeber für die IVD-Industrie zu sein, darf nicht verloren gehen. Restriktionen führen unweigerlich zu einem Verlust an Expertise zur Etablierung von Inhouse-Tests in medizinischen Laboren. Auch würde die Reaktionsgeschwindigkeit auf neue bedrohliche Entwicklungen, wie z. B. die COVID-19-Pandemie, vermindert oder gänzlich entfallen. Artikel 5 (5) d) sollte deshalb gestrichen werden.
Software als IVD aus Eigenherstellung
Im Bereich Software schießt der Normengeber eindeutig über das Ziel einer sinnvollen Regulation hinaus. Be-reits ein Excel-Sheet, mit dessen Hilfe aus zwei oder mehreren Parametern ein Score für einen Patienten ermittelt wird, stellt entsprechend der Definition der IVDR streng genommen ein In-vitro-Diagnostikum dar, die weitaus fehleranfälligere Berechnung auf Papier jedoch nicht.
Deshalb sollte Software, die nur mathematische Berechnungen oder einfache logische Operationen ausführt (z. B. Scores aus mehreren Parametern; logische Integration und Befundung zusammengehörender Testergebnisse) und deren Ergebnisse in einen ärztlich validierten Befund einfließen, generell von den Regelungen der IVDR ausgenommen sein. Weiterhin sollten Regeln für komplexere Software, die im Sinne eines Expertensystems den Arzt bei der Be-fundinterpretation unterstützt, auf ein sinnvolles und realisierbares Maß be-schränkt werden.
Zusammenfassung
Die am 26. Mai in Kraft tretende IVDR stellt Hersteller von diagnostischen Tests aber auch die Anwender in den Laboren vor umfangreiche neue Herausforderungen. In den Laboren sind besonders In-vitro-Diagnostika aus Eigenherstellung betroffen, deren Einsatz in Zukunft erschwert, wenn nicht unmöglich gemacht wird. Regulation behindert so Innovation und verschlechtert im Sinne eines ungewollten Kollateralschadens die Patientenversorgung.
Ärzte, auch Laborärzte, klagen seit Jahrzehnten über die zunehmende Bürokratisierung des Praxisalltags, ohne dass eine Tendenz zur Änderung sichtbar wird. Mit der IVDR wird dieser Kurs nun auf europäischer Ebene im Bereich der Labordiagnostika fortgesetzt. Die mit der IVDR intendierte Verbesserung der Patientensicherheit verhält sich nicht automatisch proportional zur Regelungsdichte. Auch im Labor ist die Patientensicherheit in erster Linie das Ergebnis von verantwortlichem ärztlichen Handeln. Hierauf sollten wir unsere Ressourcen konzentrieren.
In dieser Ausgabe

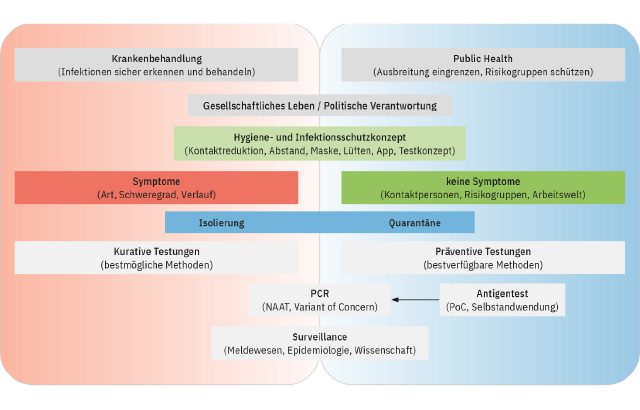
COVID–19 ist eine globale und bedrohliche Infektionserkrankung — neben vielen anderen
COVID-19 beherrscht seit zwei Jahren weltweit das gesellschaftliche Miteinander. Doch was kommt danach?

Die Datenerhebung des ALM e.V. zur SARS-CoV-2-PCR-Testung: „Woche für Woche — ein Kraftakt für alle“
Ein Interview mit Uli Früh, der seit Beginn der Pandemie die Abfragen aus über 180 Laboren koordiniert und auswertet

Intensivierung der praktischen Ausbildung in den Laboren bei ungeklärter Finanzierung
Die gesetzlichen Grundlagen der MTLA-Ausbildung ab 2023 leiden an einer massiven Finanzierungslücke
FBREK: Gefährdung der fachärztlichen humangenetischen Versorgung
Die Zertifizierung von FBREK bedeutet keine Verbesserung der Versorgung betroffener Familien – im Gegenteil.

Labore: Plötzlich im Fokus der Öffentlichkeit
Erfahrungen aus zwei Jahren PR-Arbeit während der Pandemie
10.000 Follower und 300 Tweets später — ein Resümee
Anfang 2020 folgten dem ALM e. V. auf Twitter 35 Personen, zwei Jahre später sind es 10.870